Kollagen
Kollagen
Kollagen er et protein, der produceres naturligt i kroppen, og det er fundamentet for vores hud, hår og knogler.
Det sørger for, at vores hud holder sig sund, ungdommelig og fyldig. Fordi det dannes naturligt i vores kroppe, begynder kollagenproduktionen at aftage, når vi bliver ældre. Andre faktorer, såsom soleksponering, rygning eller sukkerforbrug, bidrager også til kollagentab. Dette tab af kollagen vil resultere i fine linjer og rynker samt mindre fylde og glød.
Vores kollagenserum stimulerer kollagenproduktionen og giver din hud et mere glat og fyldigt udseende.
Kollagenserum kan bruges i kombination med alle vores andre serummer.
Vi anvender Collagen BioStine HP (f) fra firmaet Bio-Nest, Taiwan. BioStine HP (f) Collagen har oprindelse fra fiskeskæl, som primært indeholder type I Collagen. Denne råvare består af Hydrolyzed Collagen, samt Euglena Gracilis Polysaccharide, som er komplekse kulhydrater fra algen Euglena Gracilis.
PRODUKTER MED KOLLAGEN
ALT DU BØR VIDE OM
OM KOLLAGENKollagen – også stavet collagen – er en gruppe af 28 forskellige typer af proteiner og er det mest almindelige protein i dyreriget. Evolutionært er collagen et meget ”gammelt” protein – man har fx fundet intakt collagen i 68 mio år gammel Tyrannosaurus rex fossiler. I menneskekroppen udgør collagen omkring 30 % af hele proteinmassen og omkring 75 % af tørvægten af huden er collagen. Collagen findes især i bindevæv – fx i knogler, brusk, sener, led og huden.
De 28 typer af collagen betegnes med romertal nummeret efter hvornår de blev opdaget – der er fx Collagen I (prototypen, som blev opdaget først), Collagen II, Collagen III osv. De kan inddeles i 8 familier, hvoraf fx Collagen I og III hører til de fibril-formende collagener, mens fx collagen XIII hører til de transmembrane collagener. Fælles for alle collagener – det som definerer et collagen-molekyle – er en særlig struktur i molekylet kaldet et triplex helix, som består af tre strenge af aminosyrer-kæder (peptider) som snor sig højre om hinanden og danner en meget stabil struktur. Det som primært gør de 28 typer af collagener forskellige, er de andre segmenter (domæner) der er i proteinstrukturerne og de tredimensionelle strukturer de danner. Triplex helix strukturen udgør dermed en større eller mindre del af collagen-typerne – fx består Collagen I af 96 % triplex helix struktur, mens det er under 10 % i Collagen XII.
KOLLAGENS EGENSKABER I HUDEN
I huden er 70-90% af collagenet af typen Collagen I, mens 10-20 % er Collagen III – der findes mindre mængder af fx Collagen V, VII og XVII. De findes især i den ekstracellulære matrix (mellem cellerne) sammen med andre stoffer som elastin og glycosaminoglycaner (fx hyaluronater og dermatan sulphate), hvor det bl.a. giver struktur og elasticitet til huden. Collagen er også vigtig i sårhelingsprocessen. Det ses fx ved sygdommen skørbug, hvor symptomer som blødende tandkød og manglende sårheling opstår, fordi mangel på Vitamin C gør, at der ikke bliver produceret ordentlig collagen, da vitamin C er en vigtig co-faktor for visse enzymer, som spiller en afgørende rolle i dannelsen af triplex helix strukturen i collagen. Der findes også en lang række andre sygdomme, som skyldes fejl i dannelsen af collagen eller direkte genmutationer i collagen-generne.
HVAD SKER DER MED KOLLAGEN, NÅR HUDEN ALDRES?
Der er en vis omsætning (turnover) af collagen, som er ret præcist kontrolleret og varierer med alderen. Collagen og elastin ret stabile proteiner, hvis halveringstid måles i år – hvert molekyle bliver dermed udsat for en del undervejs og det akkumulerer løbende småskader i sin struktur, som forringer dens funktion. Matrix Metalloproteinaser (MMP’er) er de enzymer som starter nedbrydningen af collagen – fx kløves Collagen I, II og III af bl.a. MMP-1, MMP-8 og MMP-13 – hvorefter andre nedbrydende enzymer arbejder videre med collagen-komponenterne. Aktiviteten af MMP-enzymer er associeret med UV-stråling og oxidativ stress i huden med fri radikaler. Efterhånden som man bliver ældre falder produktionen og kvaliteten af collagen i huden. Indholdet af collagen topper omkring 30-årsalderen og derefter reduceres mængden med ca 1-1,5 % per år – sammen med associerede extracellulære komponenter, således at når man er omkring 70 år er mængden ca 25 % af max. Faldet af collagen-indholdet og kvaliteten af collagenet er korreleret med aldring af huden såsom rynker.
KOLLAGEN BIOSYNTESE
Proteiner bliver syntetiseret efter samme grundlæggende procedure: Det centrale dogme, som beskriver hvordan proteiner bliver syntetiseret ud fra den genetisk information der ligger i DNA’et. Kort fortalt bliver genet i DNA’et (efter der er kommet et signal) ”åbnet” således at det kan blive kopieret (transkriberet) til et RNA-molekylet kaldet et messenger-RNA (mRNA). Dette sker inde i cellekernen. mRNA-molekylet kommer ud i cellens cytoplasma, hvor særlige enheder kaldet ribosomer oversætter (translaterer) mRNA-koden til aminosyrer, der sættes sammen til en peptid-kæde – en lang kæde af aminosyrer. Denne bliver i nogle modificeret lidt (post-translationel modifikation), hvorefter den foldes til en helt bestemt tredimensionel struktur – evt sammen med andre peptidkæder for at danne det endelige protein. Således er proteiner generelt meget store molekyler, som kan bestå af flere peptidkæder.
I den følgende beskrivelse af syntesen af collagen og dennes struktur vil fokus være på Collagen I, som er det mest udbredte collagen i huden.
Fibroblaster er hudceller i dermis, som producerer det meste Collagen I i huden. På overfladen af cellen er der en lang række receptorer, hvoraf nogle kan binde signalmolekyler, der leder til aktivering af cellen og starter processen med at producere collagen. Inde i cellekernen bliver de specifikke gener for de tre peptid-kæder transcriberet til mRNA, som derefter ledes ud i cellens cytomplasma, hvor de via ribosomer translateres til aminosyrer, der sættes sammen til peptidkæder.
Hver peptidkæde består af 1050 aminosyrer og for Collagen I består den af to α1(I) kæder og én α2(I) kæde (andre collagener består af tre ens kæder eller tre forskellige kæder). Specielt for collagen er, at aminosyre-frekvensen som generelt gentages gennem hele kæden, er Glycin-X-Y, hvor X og Y normalt er aminosyrerne prolin og hydroxyprolin – det er denne aminosyresekvens, som er afgørende for dannelsen af den vigtige triplex helix struktur. Peptidkæderne ledes direkte ind i et membransystem-organel kaldet endoplasmatisk reticulum, hvor de tre procollagen peptidkæder undergår en række processer (posttranslationelle modifikationer) – bl.a. glycosylation, hvor der sættes nogle bestemte sukkermolekyler på bestemte positioner, hydroxylering af visse prolin- og lysin-aminosyrer, og endelig disulfid-bindinger mellem de tre kæder, som fører til, at de lidt som en lynlås, låser sig sammen i den velkendte højredrejede triplet helix. Derefter bliver dette procollagen via en vesikel ledt ud af cellen til det extracellulære rum, hvor extracellulære enzymer fjerne enderne af procollagenet. Dette resulterer i strukturen der kaldes tropocollagen, som for Collagen I stort set kun består af en triplet helix, som er 300 nm lang og ca 1,5 nm i diameter. Denne fjernelse af enderne gør, at molekylet kan danne bindinger (Crosslinks) til andre triplex helixer af collagen I og dermed danne større strukturer kaldet collagen fibriller, som har en særlig struktur der i elektronmikroskopi viser sig som en stribet struktur. Collagen I fibriller har en diameter på 50-200 nm. Fibrillerne kan derefter samlet sig til endnu større fiber-strukturer af collagen I, som fx i sener er op til 1 cm lang og 500 nm i diameter.
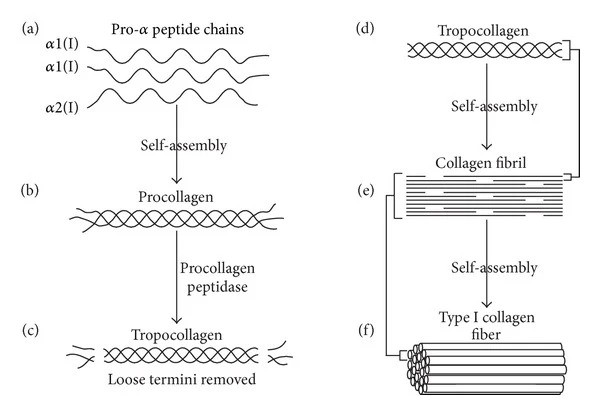
Figur 1 Collagen I biosyntesen: (a) To identiske α1(I) og én α2(I) peptidkæder samler sig og danner procollagen (b). (c) Procollagen peptidase-enzymet fjerner de ”løse” ender for derved at danne tropocollagen (d). Tropocollagen molekylet samles med andre Tropocollagener og danner dermed et voksende collagen I fibril (e). Disse collagen fibriller kan derefter sammen danne Collagen I fiber (f). Denne figur er fra artiklen ”Collagen Scaffolds in Bone Sialoprotein-Mediated Bone Regeneration” af Kruger, T. E.; Miller, A. H.; Wang, J. Udgivet i The Scientific World Journal, vol. 2013, Article ID 812718, 6 pages, 2013.
KOLLAGEN I KOSMETIK
Collagen er en meget stor og uopløselig struktur i sig selv, som ikke vil kunne komme gennem huden; – men den kan danne en film (sammenhængende struktur), som reducerer vandtab fra huden og dermed virker fugtbevarende – også idet collagen kan binde vand til sig.
I mange tilfælde bruger man i kosmetik hydrolyseret collagen, som typisk først er blevet denatureret og derefter enzymatisk nedbrudt til mindre dele, som kan variere meget i størrelse og kapacitet til at trænge ind i huden. Det er fx blevet vist at nogle collagen hydrolysater har antioxidantive og fugtgivende egenskaber og reparerende egenskaber for skadet hud.
Der findes flere naturlige kilder til collagen: Svin, kvæg og marine dyr som fisk. Kvæg-collagen er lettilgængelig og brugbart til nogle biomekaniske formål, men desværre ret heterogen. Den kan også være immunogen (kan fremkalde immunreaktion), og miste den strukturelle intregritet under isolationsprocessen og sammen med collagen fra svin er der risikoen for zoonotiske sygdomme, som BSE (Bovin Spongiform Encephalopati – kogalskab). Collagen fra marin kilde er mindre varmestabil, men har egenskaber som gør den interessant i kosmetisk sammenhæng. Ligesom ved andre naturlige kilder er der risiko for batch-til-batch variationer, som kan være svære at styre.
En anden vej at gå er, at syntetisere mindre peptider i laboratoriet med samme eller lignende aminosyre-sekvens som i collagen – det kan være små di- eller tripeptider (bestående af to eller tre aminosyrer) eller større strukturer, som kan danne triplex helix lignende dem i collagen. Endnu en vej er at fremstille genmodificerede celler (fx celler fra byg eller tobakplanten), som kan producere collagen under mere styrede forhold.
ANVENDELSEN AF COLLAGEN
Ud over brug i kosmetik bruges collagen i mange andre sammenhænge – fx som fillers, hvor en lille mængde collagen injiceres ind i huden for at udbedre fx rynker og i medicinske sammenhænge til fx sårheling. Collagen findes også som kosttilskud (typisk sammen med en række vitaminer og andre naturlige stoffer), hvor formålet er at forbedre hudens struktur. Nogle studier viser effekter på huden med meget sammensatte kosttilskud, hvor collagen indgår. Teorien bag er at collagenet efter indtag bliver nedbrudt i maven til primært aminosyrer og ca 10 % bliver til små di og tri-peptider, som optages i blodet og fordeles rundt i kroppen – fx til huden, hvor cellerne kan bruge aminosyrerne som ”byggeklodserne” til biosyntese af collagen. Studier viser at di-peptider med hydroxyprolin kan stimulere fibroblaster via receptorer og dermed inducere collagen syntese.
KILDER
Aguirre-Cruz, G.; León-López, A.; Cruz-Gómez ,V.; Jiménez-Alvarado, R., Aguirre-Álvarez, G. Collagen Hydrolysates for Skin Protection: Oral Administration and Topical Formulation. Antioxidants (Basel). 2020 Feb 22;9(2):181.
Avila Rodríguez, M. I.; Rodríguez Barroso, L.G.; Sanchez, M. L. Collagen: A review on its sources and potential cosmetic applications. Journal of Cosmetic Dermatology 2018; 17: 20-26.
Kruger, T. E.; Miller, A. H.; Wang, J. Collagen Scaffolds in Bone Sialoprotein-Mediated Bone Regeneration. The Scientific World Journal, vol. 2013, Article ID 812718, 6 pages, 2013
Lodish, H., Berk, A.; Zipursky, S.L., et al. Molecular Cell Biology. 4th edition. New York: W. H. Freeman; 2000. Section 22.3, Collagen: The Fibrous Proteins of the Matrix.
Lokaliseret 19. Juli 2021: https://www.ncbi.nlm.nih.gov/books/NBK21582
Reilly, D.M.; Lozano, J. Skin collagen through the lifestages: importance for skin health and beauty. Plastic and Aesthetic Research 2021; 8:2.
Ricard-Blum, S. The collagen family. Cold Spring Harbor perspectives in biology. 2011 Jan 1;3(1):a004978.
Shoulders, M.D.; Raines, R.T. Collagen structure and stability. Annual review of biochemistry, 2009, vol. 78, 929–958.
Sionkowska, A.; Adamiak, K.; Musiał, K.; Gadomska, M. Collagen Based Materials in Cosmetic Applications: A Review. Materials 2020, 13, 4217.




