Aminosyrer
Aminosyrer - Livets byggesten
Aminosyrer er små organiske molekyler, som spiller en afgørende rolle i alt levende. De udgør byggestenene til alle peptider og proteiner, og har også mange andre funktioner i sig selv. Nogle aminosyrer fungerer som signalmolekyler og nogle er forstadier (precursors) til andre vigtige stoffer såsom neurotransmittere og hormoner.
Proteiner kan betegnes som kroppens ”arbejdsmolekyler”. De muliggør stort set alle biokemiske processer.
Eksempler på proteiner er:
- Hæmoglobin, der transporterer ilt i blodet
- Keratin, som udgør størstedelen af hår og negle og sammen med proteinerne kollagen og elastin er helt afgørende for hudens struktur og funktioner
- Aktin og myosin, der står for muskelkontraktion
- Receptorer og ionkanaler, som formidler signaler
- Antistoffer i immunsystemet
- Enzymer, der nedbryder næringsstoffer og faciliterer livsvigtige biokemiske reaktioner.
Ligesom proteiner er peptider vitale for livet, med mange forskellige egenskaber såsom antimikrobielle, antivirale, immunmodulerende og anti-inflammatoriske1.
I alt findes der 20 standardaminosyrer, der er generelle for alt liv på jorden og som er kodet direkte i det genetiske materiale - DNA. Hertil kommer specielle aminosyrer som selenocystein og pyrrolysin, der i fx mennesket kan inkorporeres gennem særlige mekanismer i proteiner og derudover er der stor variation mellem forskellige organismers aminosyrer. Man har identificeret over 300 forskellige aminosyrer i naturen.
Blandt de 20 standardaminosyrer er nogle essentielle for mennesket og må tilføres gennem kosten. Andre er betinget essentielle – også kaldet semi-essentielle - og nødvendige under særlige forhold, mens de resterende er ikke-essentielle, idet kroppen selv kan syntetisere dem i tilstrækkelig grad. Gode kilder til aminosyrer i fødevare er fx kød, æg, fisk, mejeriprodukter og bælgfrugter.
Aminosyrer spiller ikke kun mange roller i naturen, men bliver også anvendt bredt i forskellige industrier og produkter – især inden for fødevarer, dyrefoder, medicin, kosttilskud og kosmetik. Ud over at blive anvendt direkte som aminosyrer, bliver aminosyrer også anvendt som udgangspunkt til fremstilling af andre stoffer; fx til fremstilling af relativt milde overfladeaktive stoffer (surfaktanter) og hårplejende ingredienser.
Uden aminosyrer ville liv på jorden ikke eksistere – de er fundamentale byggesten for livets kemi. De er en forudsætning for dannelsen af proteiner, peptider og en lang række andre vitale stoffer for alle kendte levende organismer.
PUCA PURE & CARE anvender i sine produkter fx aminosyrerne arginin, prolin og serin og derudover anvendes aminosyren glycin til fremstillingen af den relativt milde surfaktant Potassium Cocoyl Glycinate og flere af produkterne indeholder peptider og hydrolyserede plante-proteiner.
1Læs mere om peptider her på siden
Aminosyrer - opdagelser og det centrale dogme
Opdagelsen af aminosyrer går mere end 200 år tilbage. I 1806 lykkedes det første gang at isolere en aminosyre fra asparges, og stoffet fik senere navnet asparagin. I de følgende årtier blev de øvrige aminosyrer gradvist identificeret, og deres kemiske strukturer blev efterhånden kortlagt. Den sidste af de 20 standardaminosyrer, threonin, blev først opdaget i 1935.
I begyndelsen af 1900-tallet kom den afgørende erkendelse, at proteiner og peptider er opbygget af netop aminosyrer. Denne indsigt lagde grunden til forståelsen af proteiner som biologiske makromolekyler og blev et vigtigt skridt mod det, der senere blev kendt som det centrale dogme i molekylærbiologien: at genetisk information i DNA transskriberes (omskrives) til RNA og derefter transplanteres (oversættes) til proteiner.
Denne fundamentale og energikrævende proces starter med transskriptionen hvor et gen i cellens DNA fungerer som skabelon for produktionen af såkaldt messenger RNA (mRNA). mRNA transporteres derefter til ribosomerne – cellens komplekse proteinfabrikker – hvor translationen fra mRNA til aminosyre-kæde finder sted. mRNA består af en kæde af nukleotider2, hvis fire mulige baser bærer den genetiske kode.
De fire mulige baser er adenin (A), guanin (G), cytosin (C) og uracil (U), og disse aflæses i sæt af tre kaldet kodons.
Således er et kodon en kombination af tre af de fire mulige nukleotider og der findes 64 mulige kodons. Enkelte af disse kodons fungere som stopsignal i translationsprocessen, mens de fleste kodons koder for en bestemt aminosyre, og der er således flere kodons som koder for samme aminosyre – fx koder de fire kodons GCT, GCC, GCA og GCG for aminosyre alanin, mens der er seks kodons som koder for arginin: CGU, CGC, CGA, CGG, AGA og AGG
Aflæsningen (translationen) af mRNA til aminosyre sker via de såkaldte transfer-RNA-molekyler (tRNA) som fungerer som adapter: det genkender et bestemt kodon på mRNA og bringer den tilsvarende aminosyre til ribosomet. Her bindes aminosyrerne sammen én for én via peptidbindinger3, så der dannes en kæde, som efterfølgende foldes og modificeres til et funktionelt protein.
2Nukleotider er de grundlæggende byggesten i DNA og RNA. Et nukleotid består af et sukker-molekyle (deoxyribose i DNA, ribose i RNA), en fosfat-gruppe og en nitrogenholdig base. Nukleotider er i DNA og RNA bundet sammen i lange kæder.
3En peptidbinding er den binding, der er mellem hver aminosyre, når de bindes sammen og danner fx proteiner. Denne binding er en amidbinding mellem carboxylsyre-gruppen på en aminosyre og amin-gruppen på en anden aminosyre.
Aminosyrer - Den kemiske opbygning
Aminosyrer er en gruppe biomolekyler, som alle indeholder to centrale funktionelle grupper: en basisk aminogruppe (-NH₂) og en sur carboxylsyregruppe (-COOH). Derudover har hver aminosyre en sidekæde, ofte omtalt som R-gruppen, som varierer fra aminosyre til aminosyre. Det er netop denne R-gruppe, der giver aminosyren sine særlige egenskaber.
Placeringen af aminogruppen i forhold til carboxylgruppen afgør, hvilken type aminosyre man har. Er aminogruppen bundet til det samme kulstofatom som carboxylgruppen (C-atomet markeret med ”α” i strukturformlen i figur 1), kaldes det en alfa-aminosyre. Sidder aminogruppen på et C-atom længere væk fra carboxylsyregruppen, kan man tale om beta- eller gamma-aminosyrer. Når man i biologi og kemi taler om “aminosyrer”, menes næsten altid alfa-aminosyrer. Alle de 20 standardaminosyrer, som indgår i proteiner, er alfa-aminosyrer og det er disse, der er i fokus her.
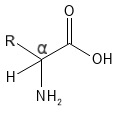
Figur 1 Den generelle kemiske struktur af en alpha-aminosyre. Bemærk det markerede α-C-atom med de fire bindinger til hhv. Carboxylsyre-gruppen (-COOH), R-sidekæden, amin-gruppen (-NH2) og H-atomet, som for tydeliggørelsen af de fire bindinger er angivet her (normalt vil H-atomet ikke være angivet i sådanne strukturformler).
I alfa-aminosyrer er der til alfa-C-atomet normalt bundet fire forskellige grupper/atomer: Carboxylsyregruppen, aminogruppen, sidekæden (R) og et H-atom. To særlige aminosyrer i denne forbindelse er prolin, hvis aminogruppe og alfa-C-atom indgår i en 5-leddet ring, så aminogruppen er en sekundær amin og der intet H-atom er på alfa-C-atomet; og glycin hvis R-gruppen er et H-atom (og således ikke har et alfa-C-atom med fire forskellige bindinger). Med undtagelse af glycin kan alle 20 standardaminosyrer danne to forskellige rummelige strukturer, som er hinandens spejlbilleder: L- og D-isomere. Dette skyldes, at alfa-C-atomet har fire forskellige bindinger og dermed fungerer som et stereocenter; de to isomere kaldes også enantiomerer. Ud over glycin, som ikke har et stereocenter, er aminosyrer i naturen generelt L-isomere. Man har dog fundet nogle D-aminosyrer fx i visse bakterier, nogle marine organismer og også i mennesket, hvor man har fundet en lille mængde af aminosyren D-serine.
Ved fysiologisk pH, hvilket normalt er 7,35-7,45 for blodet og ca. 7,0-7,4 inde i cellerne, findes aminosyrer typisk som zwitterioner, dvs. at molekylet bærer både en positiv og en negativ ladning på samme tid. Den positive ladning er på amingruppen (-NH3+), mens den negative ladning er på carboxylsyregruppen (-COO-). Ofte vil man i litteratur se kemiske strukturer uden denne pH-afhængige ladningsfordeling.
Aminosyrer - egenskaber og inddeling
Det er aminosyrernes sidekæde, der giver dem deres forskellige kemiske strukturer og dermed deres forskellige egenskaber, hvilket også kommer til udtryk i de peptider og proteiner, som de indgår i.
Man kan inddele aminosyrerne på en del forskellige måder afhængig af deres egenskaber. Blandt de fysisk-kemiske egenskaber er fx deres syre-base egenskaber, deres ladning, polaritet og opløselighed. De fleste aminosyrer er vandopløselige og normalt polære, men i forskellig grad afhængig af sidekæden. Nogle af aminosyrerne har en u-polær og hydrofob sidekæde, hvilket er vigtigt i forhold til fx deres placering i proteiner. Som nævnt er de fleste aminosyrer zwitterioner ved fysiologisk pH, men nogle af dem kan også have en ladning i deres sidekæde afhængige af miljøets pH og dermed være overordnet positiv eller negativt ladet. Sidekædernes funktionelle grupper som en OH-gruppe, et svovl-atom, et nitrogen-atom eller en ringformet struktur har også stor betydning for både de fysisk-kemiske og de biologiske egenskaber som aminosyren og proteinet har.
Set fra ernæringsmæssig og biologisk synsvinkel er aminosyrer inddelt i tre grupper:
-
Essentielle aminosyrer, som kroppen ikke selv kan danne (nok af) og derfor skal tilføres gennem kosten. For mennesker gælder det generelt ni aminosyrer: histidin, isoleucin, leucin, lysin, methionin, phenylalanin, threonin, tryptofan og valin.
Betinget essentielle også kaldet semi-essentielle aminosyrer, hvor kroppens egen produktion af aminosyren normalt er tilstrækkelig, men under visse omstændigheder ikke kan dække behovet, hvorfor tilførsel via kosten bliver nødvendig. Dette kan eksempelvis være tilfældet under perioder med hurtig vækst (spædbørn), graviditet, sygdom eller traume. De specifikke kostbehov for aminosyrer afhænger af en række faktorer, herunder udviklingsstadie, genetik, fysiologisk status, tarmens mikrobiota, miljømæssige forhold samt patologiske tilstande. På tværs af kilder fremhæves dog typisk seks aminosyrer som hørende til denne gruppe: arginin, cystein, glutamin, glycin, prolin og tyrosin.
-
Ikke-essentielle aminosyrer, som normalt produceres i tilstrækkelig mængde i kroppen. Til denne gruppe regnes ofte følgende 5 aminosyrer: alanin, asparagin, asparaginsyre, glutaminsyre og serin.
Klassificeringen af aminosyrer er ikke helt entydig i litteraturen. Eksempelvis omtales histidin i nogle kilder som essentiel, mens den i andre beskrives som semi-essentiel. Ovenstående inddeling er den klassificering man ofte finder i litteraturen. Mangel på essentielle aminosyrer kan medføre alvorlige helbredsmæssige konsekvenser og kan give mange forskellige symptomer, hvilket afspejler de mange forskellige funktioner, aminosyrerne har i kroppen. For eksempel kan utilstrækkelig forsyning af de essentielle aminosyrer føre til depression, angst, søvnløshed, udmattelse, reduktion i vækst og mental udvikling hos børn.
De 20 standardaminosyrer
I det følgende præsenteres de 20 aminosyrer i alfabetisk rækkefølge sammen med deres strukturformler, som de vil være ved fysiologisk pH. For hver aminosyre angives både tre- og et-bogstavsforkortelsen i parentes, og der lægges vægt på de mest centrale egenskaber og biologiske funktioner.
Alanin (Ala, A)
Alanin er en ikke-essentiel aminosyre, som spiller en central rolle i energiomsætningen. Den indgår i den såkaldte glukose–alanin-cyklus, hvor muskler og lever samarbejder om at balancere energibehov og kvælstofudskillelse. Når musklerne nedbryder aminosyrer under arbejde, dannes alanin, der transporteres til leveren, hvor den bruges til at producere glukose. Denne mekanisme sikrer, at musklerne kan opretholde energiforsyningen og samtidig undgå ophobning af giftig ammoniak (NH3).
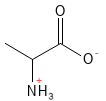
Figur 2 Den kemiske strukturformel for alanin
Arginin (Arg, R)
Arginin er for mennesket en semi-essentiel aminosyre, idet der eksempelvis hos spædbørn, samt under visse sygdomme og stress er behov for indtag via føden. For visse dyregrupper såsom fugle, katte og hunde er arginin essentiel. Arginin er involveret i en lang række processer, herunder celledeling, sårheling, immunfunktion og blodtryk. Den er forstadie til nitrogenoxid (NO), som virker karudvidende og dermed kan sænke blodtrykket. Desuden indgår arginin i dannelsen af kreatin (en vigtig energikilde til musklerne) og i ureacyklussen, der fjerner overskydende ammoniak fra kroppen. Klinisk har tilskud af arginin vist positive effekter på sårheling.
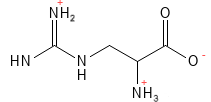
Figur 3 Den kemiske strukturformel for arginin - en af de basiske aminosyrer med en positiv ladning i sidekæden. Denne aminosyre er den med flest nitrogen-atomer, og kan ved hydrolyse fraspalte to af dem og derved danne urea, som er kroppens måde at udskille ammoniak – et giftigt restprodukt fra protein-metabolismen.
Asparagin (Asn, N)
Asparagin er en ikke-essentiel aminosyre og fungerer som en vigtig nitrogenbærer i metabolisme og proteinsyntese. Den har særlig betydning i nervesystemet, hvor den spiller en særlig rolle i udviklingen og funktionen af hjernen.
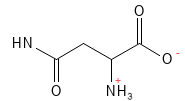
Figur 4 Den kemiske strukturformel for asparagin.
Asparaginsyre (Asp, D)
Asparaginsyre og den tilsvarende negativt ladede form, aspartat, som er den normale form ved fysiologisk pH, er en af de ikke-essentielle aminosyrer. Den er central i energiomsætningen og fungerer som forstadie (precursor) til dele af nukleotiderne i RNA og DNA og til flere andre aminosyrer fx asparagin, methionin og lysin. Desuden er denne aminosyre involveret i ureacyklussen og spiller dermed en vigtig rolle i for kroppens energi, celledeling og nitrogen-håndtering.
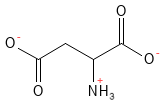
Figur 5 Den kemiske strukturformel for aspartat. Ved fysiologisk pH har asparaginsyre afgivet sit H-atom i carboxylsyre-gruppen i sidekæden hvilket giver den en negativ ladning og betegnelsen aspartat.
Cystein (Cys, C)
Cystein er en svovlholdig aminosyre, der kan dannes ud fra methionin, men under visse forhold (fx hos spædbørn eller ved sygdom) kan der være behov for ekstra tilførsel via føden – den er dermed blandt de semi-essentielle aminosyrer. Den har en særlig kemisk egenskab, idet to cystein-molekyler kan danne en kovalent disulfidbinding. Disse bindinger fungerer som “molekylære hægter”, der stabiliserer proteiners tredimensionelle struktur – et afgørende træk i fx keratin i hud, hår og negle. Cystein indgår også i tri-peptid-antioxidanten glutathion, som er en meget vigtig antioxidant, der produceres i de fleste ilt-forbrugende organismer4.
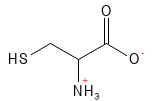
Figur 6 Den kemiske strukturformel for cystein. Med dens svovl-atom kan den sammen med en anden cystein aminosyre danne en disulfid-binding og dette molekyle bestående af to aminosyrer kaldes en cystin. Disulfid-bindingen mellem to cystein-molekyler er også vigtig i proteiners struktur – fx i keratin.
Glutaminsyre (Glu, E)
Glutaminsyre og den tilsvarende negativt ladede form, glutamat, der er den normale form ved fysiologisk pH, er en ikke-essentiel, aminosyre. Den har en særlig betydning i hjernen, hvor den fungerer som en neurotransmitter og som forstadie til neurotransmitteren GABA (gamma-aminobutyric acid), der er en vigtig hæmmende neurotransmitter. Glutamat indgår ligesom cystenin i i tri-peptid-antioxidanten glutathion. Derudover er glutamat medvirkende til at give fødevarer umami-smag.
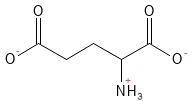
Figur 7 Den kemiske strukturformel for glutamat. Ved fysiologisk pH har glutaminsyre afgivet sit H-atom i carboxylsyre-gruppen i sidekæden hvilket giver den en negativ ladning og betegnelsen glutamat.
Glutamin (Gln, Q)
Glutamin er en af de semi-essentielle aminosyrer idet man eksempelvis ved traumer, sygdom eller i spædbarnsperioden kan have brug for mere end hvad kroppen kan danne. Den spiller en central rolle i kroppens syre-base-regulering, især i nyrerne, og er vigtig for syntesen af lipider og nukleotider. Glutamin er desuden en vigtig nitrogenbærer mellem væv og leveren og medvirker dermed til at transportere ammoniak væk fra vævet.
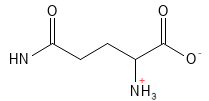
Figur 8 Den kemiske strukturformel for glutamin.
Glycin (Gly, G)
Glycin er den enkleste og mindste aminosyre, hvilket gør den meget fleksibel i proteinstrukturer. Den er en af de semi-essentielle aminosyrer (noget litteratur lister den dog som ikke-essentiel) og spiller en meget stor rolle i kroppen: fx udgør den omkring 35 % af kollagen. Glycin er også en neurotransmitter i centralnervesystemet og en del af tri-peptid-antioxidanten glutathion. Derudover giver glycin en mild, sød smag, hvilket man drager nytte af i produktionen af forskellige fødevarer.
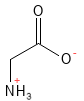
Figur 9 Den kemiske strukturformel for glycin – den simpleste og mindste af alle aminosyrerne.
Histidin (His, H)
Histidin anses generelt for at være en essentiel aminosyre, men i noget litteratur benævnes den som semi-essentiel. Denne aminosyre er forstadie til histamin, et signalstof, der er centralt i immunrespons, allergiske reaktioner og som neurotransmitter. Ligesom arginin og lysin er denne ved fysiologisk pH positivt ladet.
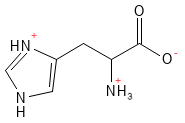
Figur 10 Den kemiske strukturformel for histidin - en af de basiske aminosyrer med en positiv ladning i sidekæden.
Isoleucin (Ile, I)
Isoleucin er en essentiel aminosyre og en af de såkaldte forgrenede aminosyrer (en BCAA: Branched Chain Amino Acid), sammen med leucin og valin. Den bidrager til energiomsætning i muskler og regulering af blodsukker. Isoleucin er også vigtig i hæmoglobin, blodets ilttransporterende protein.
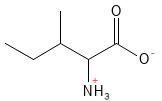
Figur 11 Den kemiske strukturformel for isoleucin; en af aminosyrerne med en forgrenet sidekæde – en såkaldt BCAA.
4Læs mere om antioxidanter her
Leucin (Leu, L)
Leucin er en essentiel aminosyre og en af de tre forgrenede aminosyrer (en BCAA: Branched Chain Amino Acid). Den er særlig vigtig for muskelvæv, da den stimulerer proteinsyntesen og hæmmer nedbrydningen af muskelproteiner. Leucin spiller også en rolle i reguleringen af blodsukker. I fødevarer fungerer den desuden som en naturlig smagsforstærker.
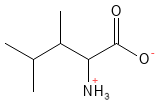
Figur 12 Den kemiske strukturformel for leucin; en af aminosyrerne med en forgrenet sidekæde - en såkaldt BCAA.
Lysin (Lys, K)
Lysin er en af de essentielle aminosyrer og en af de tre aminosyrer, der ved fysiologisk pH er positivt ladet. Den spiller en central rolle i flere vitale processer. Fx er den nødvendig for dannelsen af kollagen, den er involveret i fedtsyre-metabolismen og i epigenetisk regulering af genudtryk gennem kemiske modifikationer af histoner5. Derudover understøtter den optagelsen af calcium.
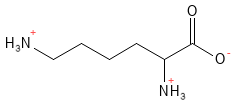
Figur 13 Den kemiske strukturformel for lysin - en af de basiske aminosyrer med en positiv ladning i sidekæden.
Methionin (Met, M)
Methionin er en essentiel, svovlholdig aminosyre, der fungerer som forstadie for flere andre biomolekyler. Den er blandt andet forstadie for dannelsen af cystein og S-adenosylmethionin (SAM-e), en vigtig methyl-donor i mange biokemiske reaktioner, herunder methylering6 af DNA og proteiner. Methionin har været anvendt i behandlingen af leversygdomme og depression, og mangel kan føre til fx tab af hårfarve.
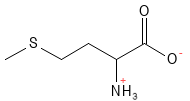
Figur 14 Den kemiske strukturformel for methionin.
Phenylalanin (Phe, F)
Phenylalanin er en essentiel aminosyre, der har stor betydning som forstadie til tyrosin. Herfra kan der dannes flere vigtige signalstoffer, herunder dopamin, adrenalin og noradrenalin, samt pigmentet melanin, som bidrager til hudens farve og beskyttelse mod solens stråler. Phenylalanin anvendes fx i behandling af depression og kroniske smerter.
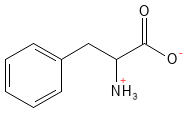
Figur 15 Den kemiske strukturformel for phenylalanin.
Prolin (Pro, P)
Prolin er ikke-essentiel og er en usædvanlig aminosyre, idet dens sidekæde danner en ringstruktur med selve aminogruppen, hvilket giver den en særlig rolle i proteinstrukturer. Denne aminosyre er afgørende for dannelsen af kollagen, hvor prolin og hydroxyprolin udgør en væsentlig del af strukturen i kollagen.
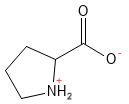
Figur 16 Den kemiske strukturformel for prolin. Bemærk hvordan sidekæden danner en 5-ledet ringstruktur med amin-gruppen, som dermed bliver en sekundær amin. I forhold til andre aminosyrer er prolin mere rigid.
Serin (Ser, S)
Serin er en ikke-essentiel aminosyre, som første gang blev isoleret fra silke, der er særligt rig på denne forbindelse. Den spiller en vigtig rolle i hjernens funktion og indgår i syntesen af nukleotider, som er byggesten i DNA og RNA. Serin er også forstadie til andre aminosyrer, herunder glycin og cystein, og medvirker i biosyntesen af folat (B9-vitamin).
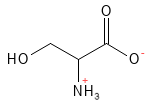
Figur 17 Den kemiske strukturformel for serin.
Threonin (Thr, T)
Threonin er en essentiel aminosyre og den sidste af de 20 standardaminosyrer, der blev opdaget (i 1935). Den indgår i dannelsen af kollagen og elastin, hvilket gør den vigtig for hudens og bindevævets struktur.
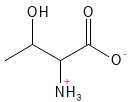
Figur 18 Den kemiske strukturformel for threonin.
Tryptofan (Trp, W)
Tryptofan er en essentiel aminosyre, som er kendt for sin rolle som forstadie til flere biologisk aktive molekyler. Den omdannes blandt andet til neurotransmitteren serotonin, der regulerer humør og søvn, samt til hormonet melatonin, som styrer døgnrytmen. Tryptofan er desuden kilde til B3-vitaminet niacin .
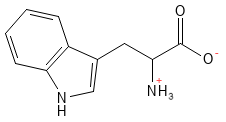
Figur 19 Den kemiske strukturformel for tryptofan - den største af de 20 standardaminosyrer.
Tyrosin (Tyr, Y)
Tyrosin er en ikke-essentiel aminosyre, da den kan dannes ud fra phenylalanin. Den er biologisk meget vigtig, fordi den er forstadie til en række signalstoffer og hormoner, herunder neurotransmitteren dopamin, som kan omdannes til hormonerne noradrenalin (norepinephrine) og adrenalin (epinephrine). Tyrosin medvirker også i dannelse af de vigtige stofskiftehormoner, der dannes i skjoldbruskkirtlen (Thyroidea) og i dannelsen af melanin-pigmentet pheomelanin, som giver hud og hår farve og bidrager til beskyttelse mod solens stråler.
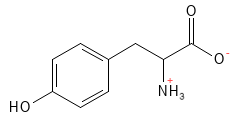
Figur 20 Den kemiske strukturformel for tyrosin.
Valin (Val, V)
Valin er en essentiel aminosyre og en af de tre forgrenede aminosyrer (en BCAA: Branched Chain Amino Acid). Den spiller en rolle i reguleringen af blodsukker, energibalancen og i muskelmetabolismen, hvor den fx har en stimulerende effekt på proteinsyntesen.
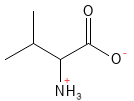
Figur 21 Den kemiske strukturformel for valin; en af aminosyrerne med en forgrenet sidekæde - en såkaldt BCAA.
5Histoner er særlige proteiner, som DNA’et er foldet omkring, og der medvirker i genreguleringen.
6Methylering er processen, hvor der sættes en methyl-gruppe (-CH3) på et molekyle. Denne proces er fx vigtig i reguleringen af gen-udtryk – dvs epigenetisk regulering.
Aminosyrer og hudens biologi
Aminosyrer spiller en central rolle for hudens struktur og funktion. De er byggesten i alle proteiner som fx elastin og kollagen, der udgør hudens grundlæggende proteinstrukturer og bidrager til styrke, elasticitet, sårheling mm. I huden findes også antimikrobielle peptider (AMP’er) som er en nøglekomponent i huden immunsystem, samt regulering af hudens mikrobiom og forsvar mod fremmede mikroorganismer.
En væsentlig del af hudens fugtbalance opretholdes af de såkaldte Natural Moisturizing Factors (NMF), hvor aminosyrer og deres derivater udgør omkring 40 %. NMF består af en blanding af salte, urea, elektrolytter samt aminosyrer, som primært stammer fra proteinnedbrydning af filaggrin7. Blandt aminosyrerne i NMF findes især serin (ca. 36 %), glycin (22 %) og alanin (13 %), men også arginin spiller en rolle. Sammensætningen kan variere mellem forskellige områder af huden, eksempelvis ses lavere serin-indhold i kind og kæbe.
Ud over deres rolle i NMF har aminosyrer og visse små peptider vist sig at kunne påvirke hudens biologi mere direkte. Studier tyder på, at indtagelse af specifikke aminosyrer eller peptider kan fremme kollagensyntesen, sårheling og endda øge hudens fugtighed og elasticitet.
Nogle peptider har eksempelvis vist sig at kunne stimulere hyaluronsyre-produktionen i keratinocytter, mens orale tilskud af glycin- og leucin-dipeptider i dyreforsøg har forbedret hudens hydrering efter UVB-eksponering.
I kosmetiske produkter anvendes aminosyrer og deres salte både som fugtgivende ingredienser og til fremstilling af andre ingredienser. Aminosyrer fremstilles typisk ved fermentering, enzymatisk katalyse eller hydrolyse af proteiner, mens enkelte – såsom glycin – også kan syntetiseres kemisk.
Aminosyrer er langt mere end blot byggesten i proteiner. De er fundamentale for kroppens vækst, udvikling og biokemiske processer, samtidig med at de har en helt central betydning for hudens struktur og funktion.
7Filaggrin er et vigtigt protein i epidermis (det yderste lag af huden), der er afgørende for hudens barrierefunktion, pH og evne til at holde på fugt. Man kan læse mere om filaggrin her.
Kilder
- Akram, M. et. Al. Amino acids: A review article. Journal of Medicinal Plants Research, 2011; 5(17), 3997–4004.
- Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. From RNA to Protein. Lokaliseret 22. August 2025: https://www.ncbi.nlm.nih.gov/books/NBK26829/.
- Arezki, N.R.; Williams, A.C.; Cobb, A.J.; & Brown, M.B. Design, synthesis and characterization of linear unnatural amino acids for skin moisturization. International Journal of Cosmetic Science. 2017; 39(1):72-82.
- CIR Expert Panel. Safety assessment of alpha-amino acids. International Journal of Toxicology, 2013; 32(6 Suppl), 59S–123S.
- Diaz I, Namkoong J, Wu J, Giancola G. Amino acid complex (AAComplex) benefits in cosmetic products: In vitro and in vivo clinical studies. Journal of Cosmetic Dermatology, 2022; 21:3046–3052.
- Fluhr, J.W.; Darlenski, R.; & Surber, C. Glycerol and the skin: holistic approach to its origin and functions. The British journal of dermatology. 2008; 159(1): 23-34.
- Gad, M. Z. Anti-aging effects of l-arginine. Journal of Advanced Research, 2010; 1(3), 169–177.
- Kamble, C.; Chavan, R.; & Kamble, V. A review on amino acids. Research & Reviews: A Journal of Drug Design and Discovery, 2022; 9(1), 1–10.
- Lopez, M.J.; & Mohiuddin, S.S. Biochemistry, Essential Amino Acids. [Updated 2024 Apr 30]. I: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. Lokaliseret 22. August 2025.
- Murakami, H.; Shimbo, K.; Inoue, Y.; Takino, Y.; & Kobayashi, H. Importance of amino acid composition to improve skin collagen protein synthesis rates in UV-irradiated mice. Amino Acids. 2012; 42(6):2481-2489.
- National Institute of General Medical Sciences. (2011, October 27). The structures of life. Chapter 1: Proteins are the body’s worker molecules.S. Department of Health & Human Services. Lokaliseret 22. August 2025: https://especialidades.sld.cu/histologia/files/2020/06/Booklet-The-Structures-of-Life.pdf.
- Nelson, D. L., & Cox, M. M. Lehninger Principles of Biochemistry (7th ed.). W. H. Freeman and Company; 2017.
- Nie, C., He, T., Zhang, W., Zhang, G., & Ma, X. Branched chain amino acids: Beyond nutrition metabolism. International Journal of Molecular Sciences, 2018; 19(4), 954.
- Nishiguchi, A., Matsumura, T., & Yoshikawa, M. Oral administration of glycine and leucine dipeptides improves skin hydration and elasticity in UVB-irradiated mice. Biomolecules & Therapeutics, 2017; 25(5), 528–534.
- PubChem Sketcher V2.4. Lokaliseret 11. September 2025: https://pubchem.ncbi.nlm.nih.gov
- Wikipedia websites: Amino acid; Aminosyre; Essential amino acid; Alanine; Arginine; Asparagine; Aspartic acid; Cysteine; Glutamine; Glutamic acid; Glycine; Histidine; Isoleucine; Leucine; Lysine; Methionine; Phenylalanine; Proline; Serine; Threonine; Tryptophan; Tyrosine; Valine. Lokaliseret 20. August 2025.
- Wu, G. Functional amino acids in nutrition and health. Amino Acids, 2013; 45(3), 407–411.
